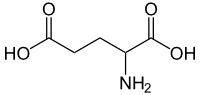
グルタミン酸
林 康紀
京都大学大学院医学研究科 システム神経薬理学分野
DOI:10.14931/bsd.1962 原稿受付日:2013年2月5日 原稿完成日:2018年1月2日
担当編集委員:和田 圭司(国立研究開発法人国立精神・神経医療研究センター)
英語名:glutamic acid 独:Glutaminsäure 仏:acide glutamique 略称:Glu, E
タンパク質を構成するアミノ酸の一つであり、ヒトを初めとする動物においては非必須アミノ酸、即ち他の有機化合物から合成する事が出来るアミノ酸である。脊椎動物中枢神経系での主要な神経伝達物質である。また、節足動物では、神経筋接合部に於ける神経伝達物質である。イオンチャネル型、代謝活性型の2種類のグルタミン酸受容体を介して作用し、主要な興奮性伝達を担う。一方で、過剰な活性は神経細胞死を引き起こす。またグルタミン酸性シナプスの異常により統合失調症、自閉症が引き起こされるとも考えられている。
発見の歴史
| Glutamic acid | |
|---|---|
| |
| |
2-Aminopentanedioic acid | |
別称 2-Aminoglutaric acid | |
| Identifiers | |
| 617-65-2 | |
| ChEBI | |
| ChEMBL | ChEMBL276389 |
| ChemSpider | 591 |
| |
| Jmol-3D images | Image |
| KEGG | D04341 |
| |
| UNII | 61LJO5I15S |
| Properties | |
| C5H9NO4 | |
| Molar mass | 147.130 g·mol−1 |
| Appearance | white crystalline powder |
| Density | 1.4601 (20 °C) |
| Melting point | 199 °C decomp. |
| 8.64 g/l (25 °C) [1] | |
| Solubility | 0.00035g/100g ethanol 25 degC [2] |
| 危険性 | |
| 特記なき場合、データは常温(25 °C)・常圧(100 kPa)におけるものである。 | |
うまみ物質から神経伝達物質へ
グルタミン酸は、Karl Heinrich Leopold Ritthausenにより1866年、小麦タンパク質であるグルテンの酸加水分解物の中から発見された[3][4]。一方、池田菊苗は、甘味、塩味、苦味、酸味とは別の味があるのに気づきうまみと名付け、昆布からその成分を抽出してグルタミン酸である事を見出した[5]。
神経組織への影響に初めて気づいたのは林髞であった。彼は、ネコの大脳皮質にグルタミン酸を投与するとネコが興奮する事に気づいた[6]。一方、LucusとNewhouseらはグルタミン酸塩の皮下注射が網膜に損傷を起こす事に気づいた[7]。この神経興奮作用と神経変性作用は現在では神経伝達物質としての機能に密接に関連した現象である事が判っているが、当時はその関係は思いもよらなかった。中枢神経組織内にあまりに多く含まれていたのが一つの原因である。そのため、早期に神経伝達物質として考えられていたカテコールアミン、アセチルコリンなどとと比較して神経伝達物質であると確立されるのは遅れた。
しかしながら、うまみ物質が神経伝達物質として機能するのは偶然ではなかろう。グルタミン酸受容体の構造は、細菌で見いだされるアミノ酸結合タンパク質と相同性がある。また単細胞生物であるシアノバクテリアにもグルタミン酸受容体が存在する[8]。その事から単細胞生物で栄養源の探索や細胞内取り込みに機能していたアミノ酸結合タンパク質がチャネル活性を得て、それが多細胞となった時に伝達物質として機能するようになったものと想像される。
薬理学ツールの発見
一方、ある物質が神経伝達物質として機能する事の証明には、まずその物質が組織に存在し合成系がある事、その物質を作用させる事でシナプス伝達と同様の現象が起こる事、その物質の拮抗薬を作用させる事でシナプス伝達も抑制される事、刺激に応じて放出される事、不活化過程がある事などがあげられる[9]。したがって、拮抗薬の存在が必須であるが、その開発は遅れていた。
J. C. Watkinsらは系統的に直鎖状のグルタミン酸分子の変異体を作ってグルタミン酸と作用を比較した。その結果、D-アスパラギン酸のアミノ基にさらにメチル基がついたN-メチル-D-アスパラギン酸(NMDA)が、グルタミン酸と比較して数十倍に上る活性を持つ事を見いだした。さらに、炭素数を一つ増やしたD体のω位(この場合はα位の炭素より最も遠い炭素を指す)のカルボン酸をホスホン酸としたD-(-)-2-アミノ-5-ホスホノペンタン酸(D-(-)-2-amino-5-phosphonopentanoic acid, AP5)がその働きを特異的に抑える事に気づいた。この事から、グルタミン酸受容体にはNMDA型ならびに非NMDA型がある事を提唱した。一方、Tage Honoréらはquinoxalinedione類であるCNQXとDNQXが非NMDA型グルタミン酸受容体を特異的に遮断することを見いだし[10] 、現在に至るまで神経系での機能を解明する道具として使われている。
竹本常松らは駆虫薬である使君子(Quisqualis indica)の種子ならびに海人草(Digenea simplex)の有効成分がそれぞれ、キスカル酸、カイニン酸であると同定した。篠崎温彦はこれらの物質が、グルタミン酸と類似している事に気づき、非NMDA型グルタミン酸受容体を活性化する事に気づいた[9]。しかもこの両者は別々な受容体を活性化した。これによりイオンチャネル型グルタミン酸受容体はNMDA型、キスカル酸型、カイニン酸の3つに分けられる事が示された。さらに、キスカル酸はイオンチャンネル型受容体を活性化するだけではなく、イノシトール-3-リン酸代謝回転も引き起こすことから、異なったメカニズムを持つ受容体の存在が示唆され[11]、キスカル酸よりイオンチャンネル型受容体特異性が高いリガンドから2-アミノ-3-ヒドロキシ-5-メチル-4-イソオキサゾールプロピオン酸 (2-amino-3-(3-hydroxy-5-methyl-isoxazol-4-yl)propanoic acid, AMPA)型受容体[12]と代謝活性型グルタミン酸受容体と呼ばれるようになった。
また神経細胞内に取り込み、さらにシナプス小胞内に貯蔵するためのトランスポーターも分子として同定され、グルタミン酸の中枢神経系における神経伝達物質としての機能は確固たるものとなった。
グルタミン酸様の構造と機能を持つ小分子をまとめて興奮性アミノ酸という。神経組織に内在性の物(アスパラギン酸)とそうでない物(カイニン酸、キスカル酸など)共にそう呼称される。
化学的性質
1個のアミノ基と2個のカルボニル基をもつαアミノ酸である。水にある程度溶け、溶液は酸性である。溶解度を上げたいときは、同濃度の水酸化ナトリウムを加えるか、一ナトリウム塩を用いる。同じ理由により、タンパク質に埋め込まれた場合も、酸性の側鎖となる。
水溶液中ではピログルタミン酸(pyroglutamateまたはピロリドンカルボン酸、pyrrolidonecarboxylic acid)に次第に変化していくため、長期には凍結保存するか、粉末から用時調整する。ピログルタミン酸を除去するのにはイオン交換樹脂を用いる。購入した[3H]-グルタミン酸などを用いる時にはこの操作が必要な場合もある。
神経伝達物質として働くまで
生合成
グルタミン酸は食中に多量に含まれているが、血中から脳へは血液脳関門の存在により移行しない[13]。その為、脳内で新たに合成される[14][15]。
- α-ケトグルタル酸からアミノ基転移酵素の働きによりその他のL-アミノ酸からアミノ基の転移を受け合成。アミノ基供与体となるアミノ酸としては分枝鎖アミノ酸(バリン、ロイシン、イソロイシン)が挙げられる[16]。
- α-ketoglutarate + α-amino acid → L-glutamate+ α-keto acid
- グルタミン酸デヒドロゲナーゼ (EC 1.4.1.3) による、α-ケトグルタル酸への遊離アンモニアの添加
- 2-oxoglutarate + NH3 + NAD(P)H + H+ → L-glutamate + H2O + NAD(P)+
- L-glutamine + H2O → L-glutamate + NH3
- オルニチンからオルニチンアミノ基転移酵素 (EC 2.6.1.13)によりΔ1-ピロリン-5-カルボン酸 (P5C)に変換され、さらにP5Cデヒドロゲナーゼ (EC 1.5.1.12)によりグルタミン酸-5-セミアルデヒドを介してグルタミン酸となる。また、プロリンもプロリン酸化酵素(EC 1.5.1.2)の作用でP5Cが産生される。
- Ornithine or proline → Δ1-pyrroline-5-carboxylic acid → L-glutamate-5-semialdehyde → L-glutamate
このように複数の経路があるが、どの経路がどの程度寄与しているかは詳細には判っていない。グルタミンから合成される経路は、一旦神経伝達物質として使われたグルタミン酸のリサイクリングに重要であると考えられている。
シナプス顆粒への取り込み
シナプス前終末内部のシナプス顆粒に小胞型グルタミン酸輸送体 (vesicular glutamate transporter, VGluT)によって濃縮される。VGluTは1-3のサブタイプが存在し、solute carrier (SLC)ファミリータンパク質に属する(VGluT1=SLC17A7、VGluT2=SLC17A6、VGluT3=SLC17A8)。また、小胞型興奮性アミノ酸輸送体 (vesicular excitatory amino acid transporter, VEAT=SLC17A5)もグルタミン酸並びにアスパラギン酸をシナプス顆粒内に輸送する[17]。
いずれも同じく小胞上にある顆粒型F0F1-ATPaseによって作られるプロトン濃度勾配とそれによって生じた電位勾配をを利用して細胞質側から顆粒内へグルタミン酸を濃縮する。最終的な顆粒内グルタミン酸濃度は100 mMに及ぶ。
イオンチャネル型受容体
グルタミン酸神経伝達のうち、早い成分を担っているのがイオンチャネル型グルタミン酸受容体である。脊椎動物ではカチオンチャネルである興奮性のグルタミン酸受容体のみである。カチオンチャネルが開くことで、神経細胞を脱分極させ、活動電位を引き起こす他、細胞内へCa2+を流入させ、細胞内情報伝達系の活性化も引き起こす。
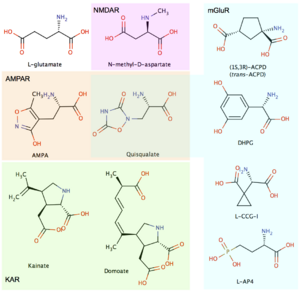
興奮性グルタミン酸受容体は次の3種に大きく分けられる。いずれも、大きな細胞外ドメインに3つの膜貫通領域(M1、M3、M4)とそれに挟まれた膜にループ状に埋め込まれるM2領域、細胞内ドメインからなる。テトラマーを形成する。
| タイプ | 名称 | 作動薬 | 阻害薬 |
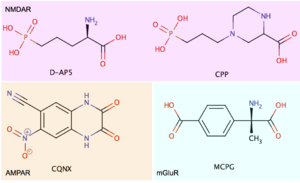
| イオンチャネル型 | NMDA型 | NMDA | D-AP5, CPP, MK801 |
| カイニン酸型 | カイニン酸 | CNQN, DNQX, GYKI 53655 | |
| AMPA型 | AMPA | CNQN, DNQX, NBQX | |
| 代謝活性型 | サブグループI | trans-ACPD, キスカル酸, DHPG | MCPG, CPCCOEt, MPEP |
| サブグループII | L-CCG-I | LY 341495, EGLU | |
| サブグループIII | L-AP4 | MAP4, MSOP |
AMPA型グルタミン酸受容体
- 古くはキスカル酸型グルタミン酸受容体といわれたが、キスカル酸は代謝活性型グルタミン酸受容体も刺激する事が判ったため、より特異的なアゴニストである2-amino-3-(3-hydroxy-5-methyl-isoxazol-4-yl)propanoic acid (AMPA)からAMPA型グルタミン酸受容体といわれるようになった。拮抗阻害薬にはCNQX、NBQXがよく用いられる。
- AMPA型グルタミン酸受容体は、通常の場合、膜電位によらず機能する。そのため、静止膜電位付近のシナプス伝達を担っている。チャネルはNa+、K+に対して透過性が高い。
- GluA1-4(以前はGluR1-4と呼ばれていた)の4つのサブタイプがあり、リガンド結合領域がFLIP型、FLOP型の選択的スプラインシング、またサブタイプによっては細胞内ドメインも選択的スプラインシングを受ける。
- GluA2サブユニットではチャネル壁を構成する一つのアミノ酸がmRNAの編集によりグルタミンからアルギニンに変化する。その他のサブユニットではグルタミンのままである。このため、GluA2を含む受容体と含まない受容体では整流特性、イオン透過性がかわっている。
詳細はAMPA型グルタミン酸受容体の項目参照。
カイニン酸型グルタミン酸受容体
- カイニン酸受容体はGluK1-3 (GluR5-7)、GluK4,5 (KA1-2)からなる。AMPA型受容体、NMDA型受容体と比較して中枢神経系での伝達の寄与は小さい。シナプス後部に存在する他、前部に存在し、神経伝達物質の放出の制御にも関わる[18]。
詳細はカイニン酸型グルタミン酸受容体の項目参照
NMDA型グルタミン酸受容体
- NMDAにより特異的に活性化される。拮抗的阻害剤としては、D-AP5、D-CPP(D-AP7を環状化したもの)、非拮抗的阻害剤としてはMK801、フェンサイクリジン、ケタミンなどが知られている。また、コアゴニストとしてグリシンまたはD-セリンを必要とする。
- 通常静止膜電位付近では、Mg2+によりチャネルが塞がれており、活性化にはある程度の脱分極が必要である。そのため、ある程度の神経活動がある時にのみ活動する。AMPA型受容体とは異なり、Ca2+透過性が高く、活性化により細胞内Ca2+濃度が上昇する。シナプス可塑性にはこのCa2+が必須である。
- 通常GluN1(NR1)、GluN2A-D(NR2A-D)から構成される。すべての受容体にGluN1は含まれる一方、GluN2は組織により特定のサブユニットが含まれており、電気生理学的特性を規定していると考えられる。また一部はGluN3A,B(NR3A,B)サブユニットも含むと考えられる。GluN3がGluN1、GluN2と複合体に共存すると、ドミナントネガティブ体として働く[19]。また、GluN1とGluN3だけ複合体を作ると、グリシン単独で開くチャネルが形成されるが[20]、実際に神経組織で、グリシン受容体として機能しているかは不明である。
詳細はNMDA型グルタミン酸受容体の項目参照
抑制性グルタミン酸受容体
また、無脊椎動物では、塩化物イオンチャネルである抑制型のグルタミン酸受容体も知られ、グルタミン酸性塩化物イオンチャネル (glutamate-gated chloride channels, GluCls)と呼ばれている[21]。この場合、神経細胞の脱分極を抑制する。この受容体は、脊椎動物のグルタミン酸受容体とは別のファミリーであり、グリシン受容体にた五量体構造をとる。無脊椎動物では神経細胞に発現し、行動制御に関わる他、腸管糞線虫症の経口駆虫薬、疥癬、毛包虫症治療薬であるイベルメクチンの標的分子として重要である。
代謝活性型受容体
リガンド結合領域を含む細胞外N末端、7回膜貫通領域、細胞内C末端からなる。Gタンパク質共役受容体の一つであるが、ロドプシンとの相同性はほとんどない。
詳細は代謝活性型グルタミン酸受容体の項目参照。
サブグループI
ホスホリパーゼCを活性化する事によりイノシトール3リン酸代謝回転/Ca2+/リン脂質依存性タンパク質リン酸化酵素 (Cキナーゼ)経路につながる。mGluR1とmGluR5により構成される。TRPチャネルを介し、遅いシナプス伝達に関与する。
サブグループII
trans-ACPD、DCG-IVにより活性化され、cAMP産生を抑制する。また、Gタンパク質活性化カリウムチャネル(GIRK)を活性化する事により、シナプス前部にて自己受容体として機能する。mGluR2とmGluR3が属する。
サブグループIII
L−AP4により活性化され、cAMP産生を抑制する。また、サブグループIIと同様にGIRKを活性化する。mGluR4、mGluR6、mGluR7、mGluR8が属する。
再取り込み
シナプス間隙に放出されたグルタミン酸は細胞膜に存在するグルタミン酸輸送体(Excitatory amino acid transporter, EAAT)によって細胞内へ取り込まれる事で不活化される。EAATはVGluTと同じくSLCタンパク質スーパーファミリーに属し、1-5までのサブタイプが存在する。EAAT1と2はグリア細胞に存在し、3、4はニューロン、5は網膜に存在する。取り込みに要するエネルギーはEAAT1-3は細胞膜内外のNa+、K+勾配、EAAT4、5はCl-勾配を用いている。
神経細胞膜に存在するEAATにより取り込まれたグルタミン酸は再利用される。グリア細胞の細胞膜に存在するグルタミン酸輸送体によりグリア細胞内に取り込まれたグルタミン酸は、一度グルタミン合成酵素(glutamine synthetase、glutamine synthase:GS)の働きでグルタミンに変換された後、神経細胞に取り込まれ、その中で再度グルタミン酸に変換された上で、再利用される。
グルタミン酸神経細胞の分布
グルタミン酸は脊椎動物中枢神経系の殆どの早い興奮性伝達物質を担っている他、遅いシナプス伝達の一部も担う。そのため、上位中枢から脊髄に至るまで、グルタミン酸性神経細胞、並びにグルタミン酸性シナプスは広く分布している。
主なグルタミン酸性神経細胞には以下のようなものがある。
一方、アセチルコリン、カテコールアミンや神経ペプチドは分布が限局しており、中枢神経では神経調節的に働くと考えられる。
一方で、脊椎動物ではアセチルコリンで担われる神経筋接合部での興奮性伝達は、無脊椎動物では神経筋接合部もグルタミン酸によって担われている。このため、カイニン酸を含む海人草抽出成分が、駆虫薬として用いられる。
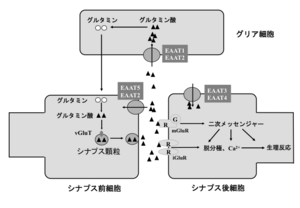
R:受容体、G:三量体GTP結合タンパク質、mGluR:代謝活性型グルタミン酸受容体、iGluR:イオンチャネル型グルタミン酸受容体
茂里、島本らによる図を改変[22]
疾患との関わり
興奮毒性
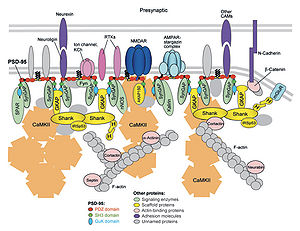
Reprinted, with permission, from the Annual Review of Biochemistry, Volume 76 © 2007 by Annual Reviews www.annualreviews.org
神経細胞の過剰な興奮は過剰なカルシウムの細胞内流入を引き起こし、細胞死を引き起こす。脳虚血では、シナプス前部からグルタミン酸が異常に流出し、神経細胞が死滅すると考えられている[24]。
詳細は、興奮毒性の項目参照。
また、ムラサキガイのもつ毒であるドウモイ酸は徳之島では駆虫薬としても用いられる興奮性アミノ酸の一つであり、カイニン酸型受容体のアゴニストとして機能する。珪藻により産生されるが、生物濃縮がかかりムラサキガイを初めとする海産生物に多量に含まれる事がある。これを食すると神経細胞死を引き起こす[25]。これが貝毒による食中毒の病態機序と考えられている。1987年11~12月、カナダ東岸で中毒が発生し、記憶喪失性貝毒として知られるようになった[26] 。
一方、かつて中華料理店症候群(Chinese restaurant syndrome)の原因としてグルタミン酸が疑われた事があったが、通常食物に含まれる程度のグルタミン酸はかなりの部分が、腸管での局所のエネルギー源として使用されてしまう[27]。また、血中へ入っても血液脳関門を越える事がないので、生理的条件下で中枢神経細胞に影響を与えるとは考えにくい。日本国内外での公的機関による食品添加物としての安全性評価の結果では毒性は否定され、現在では摂取量には特に上限を設けられていない。
自閉症
ゲノム解析の結果より、自閉症関連遺伝子が同定された。それの中にShank、ニューロリギン、ニューレキシンといった、グルタミン酸性シナプスの構成要素が見いだされている[28][29][30][31]。Shankはシナプス後部でHomerと共にシナプス後膜肥厚のframeworkを形成する。ニューロリギンは、GKAPとPSD-95を介し、Shankと結合し、一方、シナプス前部のニューレキシンと結合する(図4)。また、モデル動物においても、社会性の異常などが認められ、それは薬理学的なグルタミン酸伝達の増強によって是正される。この事は、中枢神経系におけるグルタミン酸性シナプス伝達の異常が自閉症を引き起こしている事を示唆する。ただし、これはごく一部の患者でしか認められず、自閉症全体を説明するものではない事に注意を要する。
統合失調症
麻酔薬として開発されたフェンサイクリジン(俗にエンジェルダストとも呼ばれる)が統合失調症の症状にた幻覚などを示す事が知られていた。その後、フェンサイクリジンがNMDA型グルタミン酸受容体の非拮抗型阻害剤である事が示され、グルタミン酸受容体伝達の低下が統合失調症を起こすのではないかと示唆された[32]。実際に死後脳ではグルタミン酸受容体の発現が低下している事が報告されている[33][34]。また、NR1サブユニットの発現を低下させたマウスでは社会性の低下など統合失調症様症状が出る事が知られている[35]。現在、コアゴニストを用いてNMDA型受容体の機能を増強する事で統合失調症の症状が改善しないかが試みられている。
詳細はグルタミン酸仮説(統合失調症)の項目参照。
関連項目
参考文献
- ↑ Material Safety Data Sheet
- ↑ Belitz H.-D., Grosh, W., Schieberle P.
Food Chemistry 4th revised and extended Edition
Springer Verlag Berlin Heidelberg, 2009 Google Books - ↑ Ritthausen, H.
Über die Glutaminsäure
J. prakt. Chem. 99, 454-62 (1866) PDF - ↑ Vickery HB, Schmidt CLA
The history of the discovery of the amino acids.
Chem Rev 1931;9:169–318 - ↑ 池田菊苗
新調味料に就いて
東京化学会誌, 30, 820-836 (1909) PDF - ↑
HAYASHI, T. (1952).
A physiological study of epileptic seizures following cortical stimulation in animals and its application to human clinics. The Japanese journal of physiology, 3(1), 46-64. [PubMed:13034377] [WorldCat] [DOI] PDF - ↑
LUCAS, D.R., & NEWHOUSE, J.P. (1957).
The toxic effect of sodium L-glutamate on the inner layers of the retina. A.M.A. archives of ophthalmology, 58(2), 193-201. [PubMed:13443577] [WorldCat] [DOI] - ↑
Chen, G.Q., Cui, C., Mayer, M.L., & Gouaux, E. (1999).
Functional characterization of a potassium-selective prokaryotic glutamate receptor. Nature, 402(6763), 817-21. [PubMed:10617203] [WorldCat] [DOI] - ↑ 9.0 9.1 篠崎温彦
グルタミン酸受容体の薬理学一アゴニ.ストを中心として一
日本薬理学会誌 116:125-131 (2000) PDF - ↑
Drejer, J., & Honoré, T. (1988).
New quinoxalinediones show potent antagonism of quisqualate responses in cultured mouse cortical neurons. Neuroscience letters, 87(1-2), 104-8. [PubMed:2837683] [WorldCat] [DOI] - ↑
Sugiyama, H., Ito, I., & Hirono, C. (1987).
A new type of glutamate receptor linked to inositol phospholipid metabolism. Nature, 325(6104), 531-3. [PubMed:2880300] [WorldCat] [DOI] - ↑
Honoré, T., Krogsgaard-Larsen, P., Hansen, J.J., & Lauridsen, J. (1981).
Glutamate and aspartate agonists structurally related to ibotenic acid. Molecular and cellular biochemistry, 38 Spec No(Pt 1), 123-8. [PubMed:6270543] [WorldCat] [DOI] - ↑
Oldendorf, W.H. (1971).
Brain uptake of radiolabeled amino acids, amines, and hexoses after arterial injection. The American journal of physiology, 221(6), 1629-39. [PubMed:5124307] [WorldCat] [DOI] - ↑ Shank R. P. and Campbell G. L.
Glutamate
Handbook of Neurochemistry (Lajtha A., ed.), Vol. 3, pp. 381–404. Plenum Press, New York. 1983 - ↑ Siegel G., Agranoff B., Albers R.W., Molinoff P.
Basic Neurochemistry 4th Ed.
Raven Press, New York. 1989 - ↑
Bak, L.K., Johansen, M.L., Schousboe, A., & Waagepetersen, H.S. (2012).
Valine but not leucine or isoleucine supports neurotransmitter glutamate synthesis during synaptic activity in cultured cerebellar neurons. Journal of neuroscience research, 90(9), 1768-75. [PubMed:22589238] [WorldCat] [DOI] - ↑
Omote, H., Miyaji, T., Juge, N., & Moriyama, Y. (2011).
Vesicular neurotransmitter transporter: bioenergetics and regulation of glutamate transport. Biochemistry, 50(25), 5558-65. [PubMed:21612282] [WorldCat] [DOI] - ↑
Dingledine, R., Borges, K., Bowie, D., & Traynelis, S.F. (1999).
The glutamate receptor ion channels. Pharmacological reviews, 51(1), 7-61. [PubMed:10049997] [WorldCat] - ↑
Nishi, M., Hinds, H., Lu, H.P., Kawata, M., & Hayashi, Y. (2001).
Motoneuron-specific expression of NR3B, a novel NMDA-type glutamate receptor subunit that works in a dominant-negative manner. The Journal of neuroscience : the official journal of the Society for Neuroscience, 21(23), RC185. [PubMed:11717388] [PMC] [WorldCat] - ↑
Chatterton, J.E., Awobuluyi, M., Premkumar, L.S., Takahashi, H., Talantova, M., Shin, Y., ..., & Zhang, D. (2002).
Excitatory glycine receptors containing the NR3 family of NMDA receptor subunits. Nature, 415(6873), 793-8. [PubMed:11823786] [WorldCat] [DOI] - ↑
Wolstenholme, A.J. (2012).
Glutamate-gated chloride channels. The Journal of biological chemistry, 287(48), 40232-8. [PubMed:23038250] [PMC] [WorldCat] [DOI] - ↑ 茂里康、島本啓子
グルタミン酸トランスポーターの薬理学
日本薬理学会誌 122(3), 253-264, 2003 PDF - ↑
Sheng, M., & Hoogenraad, C.C. (2007).
The postsynaptic architecture of excitatory synapses: a more quantitative view. Annual review of biochemistry, 76, 823-47. [PubMed:17243894] [WorldCat] [DOI] - ↑
Konradi, C., & Heckers, S. (2003).
Molecular aspects of glutamate dysregulation: implications for schizophrenia and its treatment. Pharmacology & therapeutics, 97(2), 153-79. [PubMed:12559388] [PMC] [WorldCat] [DOI] - ↑
Debonnel, G., Beauchesne, L., & de Montigny, C. (1989).
Domoic acid, the alleged "mussel toxin," might produce its neurotoxic effect through kainate receptor activation: an electrophysiological study in the dorsal hippocampus. Canadian journal of physiology and pharmacology, 67(1), 29-33. [PubMed:2540893] [WorldCat] [DOI] - ↑ Aurélie Lelong, Hélène Hégaret, Philippe Soudant, and Stephen S. Bates
Pseudo-nitzschia (Bacillariophyceae) species, domoic acid and amnesic shellfish poisoning: revisiting previous paradigms.
Phycologia 51: 168-216(2012) - ↑ 鳥居邦夫、三村亨
L-グルタミン酸塩類のラットにおける吸収と排泄について
医薬品研究 (1990)21: 242-256 - ↑
Sato, D., Lionel, A.C., Leblond, C.S., Prasad, A., Pinto, D., Walker, S., ..., & Scherer, S.W. (2012).
SHANK1 Deletions in Males with Autism Spectrum Disorder. American journal of human genetics, 90(5), 879-87. [PubMed:22503632] [PMC] [WorldCat] [DOI] - ↑
Pinto, D., Pagnamenta, A.T., Klei, L., Anney, R., Merico, D., Regan, R., ..., & Betancur, C. (2010).
Functional impact of global rare copy number variation in autism spectrum disorders. Nature, 466(7304), 368-72. [PubMed:20531469] [PMC] [WorldCat] [DOI] - ↑
Durand, C.M., Betancur, C., Boeckers, T.M., Bockmann, J., Chaste, P., Fauchereau, F., ..., & Bourgeron, T. (2007).
Mutations in the gene encoding the synaptic scaffolding protein SHANK3 are associated with autism spectrum disorders. Nature genetics, 39(1), 25-7. [PubMed:17173049] [PMC] [WorldCat] [DOI] - ↑
Südhof, T.C. (2008).
Neuroligins and neurexins link synaptic function to cognitive disease. Nature, 455(7215), 903-11. [PubMed:18923512] [PMC] [WorldCat] [DOI] - ↑
Sircar, R., Samaan, H., Nichtenhauser, R., Snell, L.D., Johnson, K.M., Rivier, J., ..., & Zukin, S.R. (1986).
Modulation of brain NMDA receptors: common mechanism of sigma/PCP receptors and their exogenous and endogenous ligands. NIDA research monograph, 75, 157-60. [PubMed:2828962] [WorldCat] - ↑
Meador-Woodruff, J.H., & Healy, D.J. (2000).
Glutamate receptor expression in schizophrenic brain. Brain research. Brain research reviews, 31(2-3), 288-94. [PubMed:10719155] - ↑
Konradi, C., & Heckers, S. (2003).
Molecular aspects of glutamate dysregulation: implications for schizophrenia and its treatment. Pharmacology & therapeutics, 97(2), 153-79. [PubMed:12559388] [PMC] [WorldCat] [DOI] - ↑
Mohn, A.R., Gainetdinov, R.R., Caron, M.G., & Koller, B.H. (1999).
Mice with reduced NMDA receptor expression display behaviors related to schizophrenia. Cell, 98(4), 427-36. [PubMed:10481908] [WorldCat] [DOI]